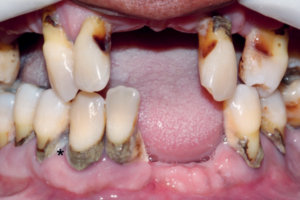
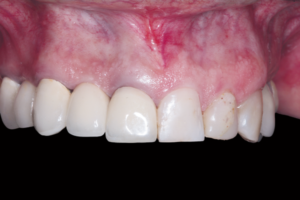
Sérgio Scombatti e convidados debatem os fatores que incentivam o uso da matriz derivada do esmalte em associação aos procedimentos periodontais.
A matriz derivada de esmalte, comercialmente conhecida como Emdogain, representa um recurso promissor para o tratamento de diferentes tipos de defeitos periodontais, incluindo os defeitos intraósseos, as lesões de furca, as recessões gengivais e os defeitos peri-implantares associados à peri-implantite.
A capacidade de modular a resposta cicatricial, aumentando a previsibilidade de regeneração em diferentes padrões de defeitos periodontais, o mecanismo biológico de ação das proteínas derivadas da matriz do esmalte sobre a superfície radicular, assim como a facilidade de manuseio clínico, têm incentivado a sua utilização em associação aos procedimentos periodontais cirúrgicos e não cirúrgicos (ou flapless), como nos casos de bolsas periodontais residuais profundas associadas a defeitos ósseos horizontais ou intraósseos.
A matriz derivada do esmalte (MDE) é um gel viscoso que funciona como biomodulador tecidual. É composta por um grupo de proteínas extraídas do esmalte de dentes suínos em desenvolvimento. Apesar da origem, este produto não apresenta reações adversas em humanos e mostrou-se seguro mesmo após múltiplas aplicações. Os principais componentes proteicos da MDE são as amelogeninas, um grupo de proteínas hidrofóbicas que correspondem a 90% da matriz e que apresentam um papel coadjuvante importante no desenvolvimento do cemento acelular, do ligamento periodontal e do osso alveolar. Os 10% restantes são constituídos por outras proteínas, como ameloblastina, amelina, tufelina, enamelina e proteínas séricas. Estas proteínas encontram-se em uma solução carreadora de alginato de propilenoglicol, que permite a aplicação da MDE na forma de gel e apresenta um efeito antimicrobiano contra os patógenos periodontais.
Após a aplicação sobre a superfície radicular previamente descontaminada, as amelogeninas presentes na MDE precipitam, formando cristais que permanecem estáveis por duas semanas, possibilitando a colonização seletiva, a proliferação e diferenciação de diferentes tipos de células, bem como a expressão de fatores de transcrição, fatores de crescimento, citocinas, constituintes de matriz extracelular e outras moléculas envolvidas na regulação da remodelação óssea, permitindo a regeneração das estruturas de suporte periodontal. Além disso, a MDE tem mostrado um potencial signifi cativo na cicatrização de feridas, favorecendo a regeneração dos tecidos moles e a atividade angiogênica.
Estudos clínicos controlados demonstraram evidências de regeneração periodontal e melhoras nos parâmetros clínicos após a utilização da MDE em diferentes tipos de defeitos periodontais, dentre eles: defeitos intraósseos, lesões de furca, defeitos tipos deiscências e recessões gengivais. Mais recentemente, a MDE passou a ser utilizada para o tratamento de defeitos ósseos peri-implantares no tratamento cirúrgico da peri-implantite, apresentando resultados promissores.
A aplicação da MDE apresenta algumas particularidades que devem ser consideradas antes de seu uso, que nem sempre são contempladas com as abordagens convencionais:
- Os procedimentos de raspagens e alisamento devem ser feitos de forma minuciosa, de modo que o processo infl amatório seja mínimo no momento da cirurgia. Muitas vezes, múltiplas sessões são necessárias.
- Evidências científicas indicam que quanto menor o sangramento, principalmente no momento da aplicação da MDE, mais efetiva é a ação do produto.
- O controle do sangramento deve garantir que a MDE entre em contato com a superfície radicular, antes mesmo que o sangue ou a saliva.
- É aconselhável a realização de uma pré-sutura previamente à colocação do gel da MDE, para minimizar o sangramento transcirúrgico
- A aplicação da MDE deve ser feita de forma passiva diretamente na superfície da raiz exposta, de apical para coronário. Lembrar-se de que a ação principal da MDE é sobre a superfície radicular. No caso de tratamento de peri-implantite, a MDE só deve ser aplicada após a descontaminação da superfície do implante.
- Quando a MDE for utilizada em associação a outros biomateriais, a mesma deve ser aplicada inicialmente sobre a superfície da raiz ou implante e depois sobre o substituto ósseo, após o preenchimento do defeito periodontal ou peri-implantar, podendo ainda ser aplicada sobre o tecido mole após a finalização da sutura.
- O paciente deve ficar sob controle rigoroso de biofilme dental por um período de seis meses, devendo ser acompanhado mensalmente pelo profissional através de consultas regulares de tratamento periodontal de suporte.
- Evidências científicas comprovaram que os resultados são tempo-dependentes, sendo que melhoras significativas nos níveis clínicos de inserção são observadas a longo prazo.
É importante destacar que, quando a MDE é utilizada em abordagens minimamente invasivas, é possível controlar de forma mais efetiva as variáveis que podem comprometer sua efetividade. A possibilidade de preservação tecidual máxima e a manutenção da estabilidade da margem gengival, assim como o melhor padrão cicatricial, têm indicado o uso sistemático da MDE em suas múltiplas indicações.
O fluxograma a seguir detalha as possibilidades de uso do biomaterial.
Finalmente, as Figuras 1 a 14 apresentam casos clínicos que exemplificam as inúmeras situações clínicas, controladas por mais de oito anos, associando ou não a MDE a substitutos ósseos, membranas e, mais recentemente, a matrizes colágenas.
Referências
- Alberti A, Francetti L, Taschieri S, Corbella S. The applications of enamel matrix derivative in implant dentistry: a narrative review. Materials (Basel) 2021;14(11):3045.
- Dumitriu AS, Didilescu AC, Giurgiu MC, Albu ŞD, Pădure CE, Nicolae XA et al. The efficiency of using enamel matrix derivative in therapeutic approach of periodontal furcation defects of maxillary and mandibular molars. Rom J Morphol Embryol 2021;62(2):401-9.
- Estrin NE, Moraschini V, Zhang Y, Miron RJ. Use of enamel matrix derivative in minimally invasive/flapless approaches: a systematic review with meta-analysis. Oral Health Prev Dent 2022;20(1):233-42.
- Iorio-Siciliano V, Blasi A, Stratul SI, Ramaglia L, Octavia V, Salvi GE et al. Healing of periodontal suprabony defects following treatment with open flap debridement with or without an enamel matrix derivative: a randomized controlled clinical study. Clin Oral Investig 2021;25(3):1019-27.
- Jentsch HFR, Roccuzzo M, Pilloni A, Kasaj A, Fimmers R, Jepsen S. Flapless application of enamel matrix derivative in periodontal retreatment: a multicentre randomized feasibility trial. J Clin Periodontol 2021;48(5):659-67.
- Miron RJ, Sculean A, Cochran DL, Froum S, Zucchelli G, Nemcovsky C et al. Twenty years of enamel matrix derivative: the past, the present and the future. J Clin Periodontol 2016;43:668-83.
- Nibali L, Koidou VP, Nieri M, Barbato L, Pagliaro U, Cairo F. Regenerative surgery versus access flap for the treatment of intra-bony periodontal defects: a systematic review and meta-analysis. J Clin Periodontol 2020;47(suppl.22):320-51.
- Queiroz LA, Casarin RCV, Dabdoub SM, Tatakis DN, Sallum EA, Kumar PS. Furcation therapy with Enamel matrix derivative: effects on the subgingival microbiome. J Periodontol 2017;88(7):617-25.
- Regazzini PF, Novaes Jr. AB, de Oliveira PT, Palioto DB, Taba Jr. M, de Souza SL et al. Comparative study of enamel matrix derivative with or without GTR in the treatment of class II furcation lesions in dogs. Int J Periodontics Restorative Dent 2004;24(5):476-87.
- Roccuzzo A, Imber JC, Stähli A, Kloukos D, Salvi GE, Sculean A. Enamel matrix derivative as adjunctive to non-surgical periodontal therapy: a systematic review and meta-analysis of randomized controlled trials. Clin Oral Investig 2022;26(6):4263-80.
- Trombelli L, Simonelli A, Quaranta A, Tu YK, Li H, Agusto M et al. Effect of flap design for enamel matrix derivative application in intraosseous defects. JDR Clin Trans Res 2021;6(2):184-94.
Coordenação:
Sérgio Luís Scombatti
Doutor em Periodontia – FOB/USP; Livre-docente em Periodontia e professor do Depto. de CTBMF e Periodontia Forp–USP.
Orcid: 0000-0002-6199-7348.
Autores convidados:
Daniela Corrêa Grisi
Mestra em Periodontia – Forp-USP; Doutora em Periodontia – Foar-Unesp; Professora voluntária do Depto. de Odontologia – Universidade de Brasília; Autora do livro “Atlas de Periodontia – Técnicas Minimamente Invasivas e Microcirúrgicas”.
Márcio Fernando de Moraes Grisi
Ex-professor associado 3 do Depto. de Cirurgia e Traumatologia Bucomaxilofacial, e Periodontia – Forp-USP; Mestre, doutor e livre-docente – Universidade de São Paulo; Autor do livro “Atlas de Periodontia – Técnicas Minimamente Invasivas e Microcirúrgicas”.