Tuberosidade maxilar: será que algum biomaterial substituto ósseo conseguiria resultados clínicos, histológicos e tomográficos ideais?
A tuberosidade maxilar (TM) é uma extensão posterior da maxila, limitada mesialmente pelo último molar irrompido e pelo seio maxilar; e distalmente pela fissura pterigopalatina e pelo processo piramidal do osso palatino. Na TM se originam fibras do músculo pterigoideo medial. É uma região óssea arredondada constituída por uma fina camada de osso cortical, contínua à crista óssea alveolar, classificada como tipo ósseo III ou IV, com abundante medula óssea1-2. A fina camada de osso cortical e osso medular poroso permite que a remoção de enxertos ósseos da TM seja realizada com cinzel, o que minimiza o trauma criado por instrumentos rotatórios – habitualmente utilizados para retirada de enxerto ósseo do ramo mandibular e da sínfise mentoniana –, além de ser menos traumática para o paciente1. Após a remoção, o bloco de enxerto ósseo da TM pode ser facilmente reanatomizado de acordo com o defeito do leito receptor e funcionar como barreira natural contra o tecido conjuntivo. O osso particulado da TM pode ser facilmente obtido com o auxílio de alveolótomos.
Estruturalmente, a análise microtomográfica da TM mostra que 70% do osso medular é constituído por poros (medula óssea). Células da TM, mantidas em cultura, proliferam ativamente e expressam marcadores típicos da linhagem osteoblástica e produzem matriz óssea mineralizada3. Embora com grande potencial de osteogênese, é possível que a TM não tenha sido clinicamente utilizada com maior frequência como área doadora de enxertos, por se acreditar que possua baixa qualidade óssea, pouco tecido ósseo disponível e pela dificuldade de abertura de boca do paciente. O exame clínico e a tomografia computadorizada fornecem informações pré-operatórias a respeito da disponibilidade óssea na TM e se o volume ósseo que pode ser removido é suficiente para o tratamento da área receptora do enxerto.
Embora não seja muito divulgado, a TM tem sido utilizada como área doadora de enxerto ósseo autógeno em bloco4, particulado5, em bloco particulado6, de enxerto conjuntivo5,7-8 e até mesmo como fonte de enxerto ósseo e de tecido conjuntivo no mesmo paciente9-11, além de ser utilizada na técnica de restauração dentoalveolar imediata12. Todas essas indicações têm uma conclusão em comum: a TM apresenta excelentes resultados clínicos e tomográficos quando utilizada como fonte doadora de enxertos de tecido ósseo e de tecido mole4-12.
(Clique na imagem para ampliar)
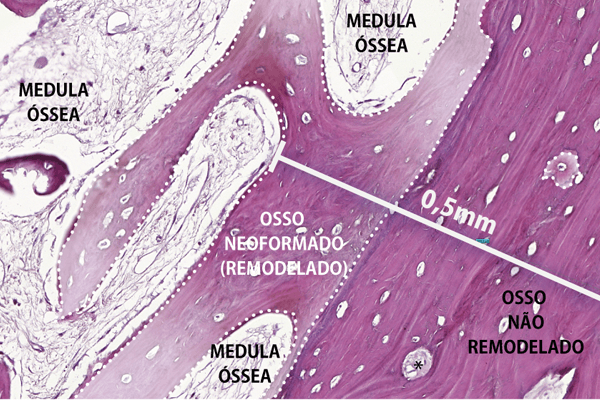
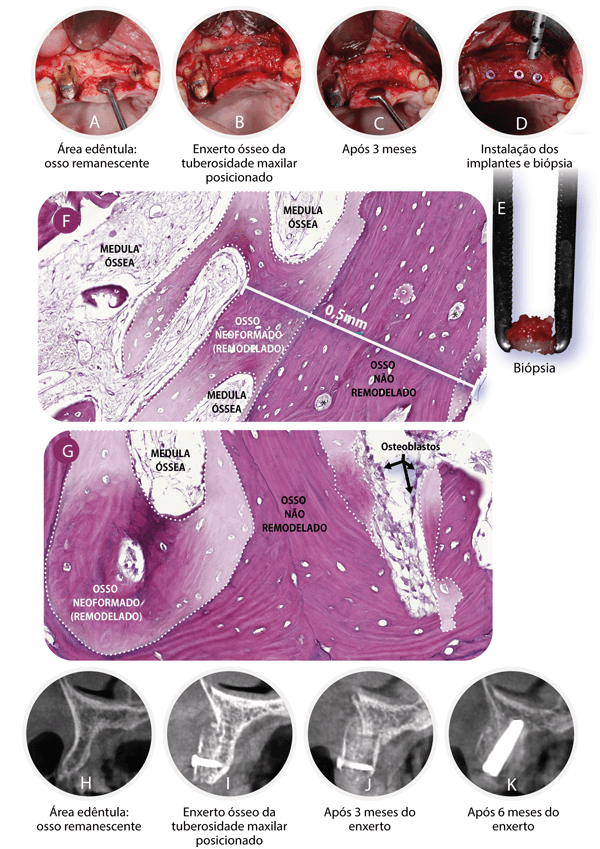
Figura 1 – A. Área edêntula com pouco osso remanescente. B. Enxerto ósseo corticomedular removido da tuberosidade maxilar e fixado no leito receptor, após a extração do dente 12. Osso corticomedular particulado posicionado em contato com o leito receptor e, sobre este, blocos de osso corticomedular parafusado e recobertos com membrana. C. Reabertura do leito receptor após três meses do enxerto ósseo. D. Implantes instalados no leito receptor e biopsia do enxerto ósseo. E. Fragmento ósseo (biopsia) removido da trefina. F. Cortical óssea do enxerto medindo 0,5 mm de espessura. Áreas de osso neoformado (remodelado) demarcadas com linhas tracejadas brancas e descoradas artificialmente para contrastar com a área de osso não remodelado (não vital). G. Osso medular (trabecular) do enxerto ósseo. Áreas de osso neoformado (remodelado) demarcadas com linhas tracejadas brancas e descoradas artificialmente para contrastar com a área de osso não remodelado (não vital). H. Corte tomográfico sagital do leito receptor antes da fixação do enxerto ósseo. I. Corte tomográfico sagital imediatamente após a fixação do enxerto ósseo no leito receptor. J. Corte tomográfico sagital do enxerto ósseo três meses após a fixação no leito receptor, imediatamente antes da instalação do implante. K. Corte tomográfico sagital do enxerto ósseo seis meses após a fixação no leito receptor, três meses após a instalação do implante.
Quando a TM é empregada como enxerto ósseo em bloco e particulado compactado em áreas após exodontia e em áreas edêntulas (Figuras 1A e 1B), pode-se observar, em apenas três meses, a consolidação clínica do enxerto ósseo suficiente para a instalação de implantes (Figuras 1C e 1D). A biopsia do enxerto ósseo da TM aos três meses (Figura 1E) mostra, na cortical, uma mescla de tecido ósseo ainda não remodelado (maduro) e remodelado (lacunas com osteócito e osso imaturo), sendo ambos importantes para a estabilidade primária e secundária do implante, respectivamente. As áreas de remodelação da cortical óssea do enxerto estão situadas principalmente na interface com o leito receptor (Figura 1F). Já o osso medular e as partículas ósseas do enxerto se encontram em estágio mais avançado de remodelação (Figura 1G).
Uma vez instalado e carregado o implante, o enxerto continua o processo de remodelação, nitidamente observado ao comparar as imagens tomográficas do leito receptor antes do enxerto (Figura 1H), do enxerto imediatamente após a fixação no leito receptor (Figura 1I), do enxerto aos três meses – imediatamente antes da instalação do implante – (Figura 1J) e aos seis meses (Figura 1K) de consolidação, sem reabsorção óssea significativa. Essa remodelação acelerada da incorporação do enxerto ósseo da TM deve estar relacionada à fina camada de osso cortical, à porosidade do osso medular e ao padrão de celularidade da TM3. Isso tudo aliado às propriedades de osseocondução, osseoindução e osteogênese própria dos enxertos ósseos autógenos13-14.
Fica a pergunta: será que algum biomaterial substituto ósseo conseguiria resultados clínicos, histológicos e tomográficos semelhantes aos apresentados nas Figuras 1?
Referências
1. Manzanera E, Llorca P, Manzanera D, García-Sanz V, Sada V, Paredes-Gallardo V. Anatomical study of the maxillary tuberosity using cone beam computed tomography. Oral radiology 2018;34(1):56-65.
2. Montanaro N, Rosa JCM, Pereira LAV, Romanos G. Role of the maxillary tuberosity in periodontology and implant dentistry: a review. Stoma Edu J 2019;6(4):249-59.
3. Martins Junior W, Ferraz EP, Beloti MM, Rosa AL, da Rosa JM. Immediate dentoalveolar restoration technique (IDR). Autograft characterization and a case report. Journal of Osseointegration 2017;9(3):305-9.
4. Khojasteh A, Nazeman P, Tolstunov L. Tuberosity-alveolar block as a donor site for localised augmentation of the maxilla: a retrospective clinical study. Br J Oral Maxillofac Surg 2016;54(8):950-5.
5. Azzi R, Takei HH, Etienne D, Carranza FA. Root coverage and papilla reconstruction using autogenous osseous and connective tissue grafts. International Journal of Periodontics & Restorative Dentistry 2001;21(2):141-7.
6. Rosa JCM, Pereira LAV. Predictable esthetic anterior maxillary reconstruction with dental implants and maxillary tuberosity grafts. In: Nevins M, Wang H-L, editors. Implant therapy: clinical approaches and evidence of success. 1. 2 ed. Quintessence Pub Co., 2019. p.175-96.
7. Dellavia C, Ricci G, Pettinari L, Allievi C, Grizzi F, Gagliano N. Human palatal and tuberosity mucosa as donor sites for ridge augmentation. International Journal of Periodontics & Restorative Dentistry 2014;34(2):179-86.
8. Rojo E, Stroppa G, Sanz‐Martin I, Gonzalez‐Martín O, Alemany AS, Nart J. Soft tissue volume gain around dental implants using autogenous subepithelial connective tissue grafts harvested from the lateral palate or tuberosity area. A randomized controlled clinical study. Journal of clinical periodontology 2018;45(4):495-503.
9. da Rosa JCM, de Oliveira Rosa ACP, Fadanelli MA, Sotto-Maior BS. Immediate implant placement, reconstruction of compromised sockets, and repair of gingival recession with a triple graft from the maxillary tuberosity: a variation of the immediate dentoalveolar restoration technique. The Journal of prosthetic dentistry 2014;112(4):717-22.
10. Raghoebar GM, Meijer HJA, van Minnen B, Vissink A. Immediate reconstruction of failed implants in the esthetic zone using a flapless technique and autogenous composite tuberosity graft. J Oral Maxillofac Surg 2018;76(3):528-33.
11. Zufía J, Blasi G, Gómez‐Meda R, Blasi A. The four‐layer graft technique, a hard and soft tissue graft from the tuberosity in one piece. Journal of Esthetic and Restorative Dentistry 2019;31(4):304-10.
12. Rosa JC, Rosa AC, Francischone CE, Sotto-Maior BS. Esthetic outcomes and tissue stability of implant placement in compromised sockets following immediate dentoalveolar restoration: results of a prospective case series at 58 months follow-up. International Journal of Periodontics & Restorative Dentistry 2014;34(2):199-208.
13. Pereira LAVD, Costa CFP. Biologia da incorporação do enxerto ósseo autógeno em bloco: cortical versus medular. ImplantNewsPerio 2020;5(1):42-4.
14. Pereira LAVD, Costa CFP, Rosa JCM. Biologia do enxerto ósseo autógeno: melhor em bloco ou particulado/raspado? ImplantNewsPerio 2020;5(2):230-2.
Leia também “Biologia do enxerto ósseo autógeno: melhor em bloco ou particulado/raspado?”, coluna de Luis Antonio Violin Pereira e convidados na revista ImplantNewsPerio.
Coordenação:

Luis Antonio Violin Pereira
Professor titular do Depto. de Bioquímica e Biologia Tecidual da Universidade Estadual de Campinas – Instituto de Biologia (Unicamp-IB).
Orcid: 0000-0002-9332-7285.
Colaboração:

Carolina Frandsen Pereira da Costa
Ilustradora; Doutoranda no programa de pós-graduação em Biologia Celular e Estrutural do Instituto de Biologia (Unicamp-IB).
Orcid: 0000-0001-8009-0517.

José Carlos Martins da Rosa
Especialista em Implantodontia e Periodontia. e mestre e doutor em Implantodontia pela Faculdade de Odontologia São Leopoldo Mandic, Campinas.